- Alcohol primario: se utiliza la Piridina (Py) para detener la reacción en el aldehído Cr03 / H+ se denomina reactivo de Jones, y se obtiene un ácido carboxílico.
- Alcohol secundario: se obtiene una cetona + agua.
- Alcohol terciario: si bien se resisten a ser oxidados con oxidantes suaves, si se utiliza uno enérgico como lo es el permanganato de potasio, los alcoholes terciarios se oxidan dando como productos una cetona con un número menos de átomos de carbono, y se libera metano.
Nomenclatura de alcoholes

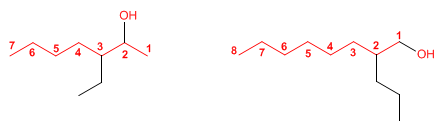
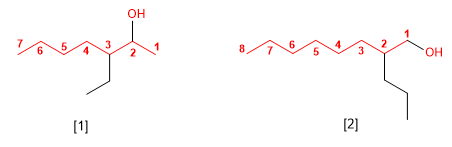
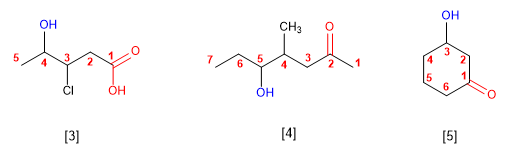
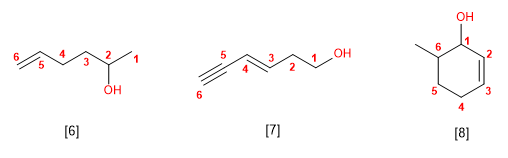
VISITA LOS SIGUIENTES LINKS, HALLARAS INFORMACIÓN NECESARIA PARA LA COMPRENSIÓN DE LOS ALCOHOLES:
