ALCANOS
AnaLizar y comprender:
Generalidades de los alcanos.
Nomenclatura de los alcanos.
Clasificacionde los alcanos.
Propiedades físicas de los alcanos.
Propiedades quimicas de los alcanos (reacciones
Síntesis u obtención de los alcanos,
Fuentes y usos de los alcanos.
Septiembre 16 de 2011
Tomado de: https://es.wikipedia.org/wiki/Alcano
Los alcanos son hidrocarburos, es decir que tienen sólo átomos de carbono e hidrógeno. La fórmula general para alcanos alifáticos (de cadena lineal) es CnH2n+2, y para cicloalcanos es CnH2n. También reciben el nombre de hidrocarburos saturados.
Los alcanos son compuestos formados solo por átomos de carbono e hidrógeno, no presentan funcionalización alguna, es decir, sin la presencia de grupos funcionales como el carbonilo (-CO), carboxilo (-COOH), amida (-CON=), etc. La relación C/H es de CnH2n+2 siendo n el número de átomos de carbono de la molécula, (como se verá después esto es válido para alcanos de cadena lineal y cadena ramificada pero no para alcanos cíclicos). Esto hace que su reactividad sea muy reducida en comparación con otros compuestos orgánicos, y es la causa de su nombre no sistemático: parafinas (del latín, poca afinidad). Todos los enlaces dentro de las moléculas de alcano son de tipo simple o sigma, es decir, covalentes por compartición de un par de electrones en un orbital s, por lo cual la estructura de un alcano sería de la forma:
donde cada línea representa un enlace covalente. El alcano más sencillo es el metano con un solo átomo de carbono. Otros alcanos conocidos son el etano, propano y el butano con dos, tres y cuatro átomos de carbono respectivamente. A partir de cinco carbonos, los nombres se derivan de numerales griegos: pentano, hexano, heptano.
Los alcanos experimentan fuerzas intermoleculares de van der Waals y al presentarse mayores fuerzas de este tipo aumenta elpunto de ebullición además los alcanos se caracterizan por tener enlaces simples.3
Hay dos agentes determinantes de la magnitud de las fuerzas de van der Waals:
- el número de electrones que rodean a la molécula, que se incrementa con la masa molecular del alcano
- el área superficial de la molécula
Bajo condiciones estándar, los alcanos desde el CH4 hasta el C4H10 son gases; desde el C5H12 hasta C17H36 son líquidos; y los posteriores a C18H38 son sólidos. Como el punto de ebullición de los alcanos está determinado principalmente por el peso, no debería sorprender que los puntos de ebullición tengan una relación casi lineal con la masa molecular de la molécula. Como regla rápida, el punto de ebullición se incrementa entre 20 y 30 °C por cada átomo de carbono agregado a la cadena; esta regla se aplica a otras series homólogas.3
Un alcano de cadena lineal tendrá un mayor punto de ebullición que un alcano de cadena ramificada, debido a la mayor área de la superficie en contacto, con lo que hay mayores fuerzas de van der Waals, entre moléculas adyacentes. Por ejemplo, compárese el isobutano y el n-butano, que hierven a -12 y 0 °C, y el 2,2-dimetilbutano y 2,3-dimetilbutano que hierven a 50 y 58 °C, respectivamente.3 En el último caso, dos moléculas de 2,3-dimetilbutano pueden "encajar" mutuamente mejor que las moléculas de 2,2-dimetilbutano entre sí, con lo que hay mayores fuerzas de van der Waals.
Por otra parte, los cicloalcanos tienden a tener mayores puntos de ebullición que sus contrapartes lineales, debido a las conformaciones fijas de las moléculas, que proporcionan planos para el contacto intermolecular.
Punto de fusión
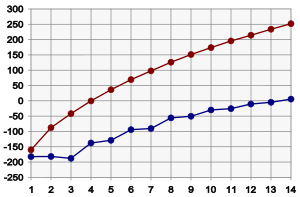
El punto de fusión de los alcanos sigue una tendencia similar al punto de ebullición por la misma razón que se explicó anteriormente. Esto es, (si todas las demás características se mantienen iguales), a molécula más grande corresponde mayor punto de fusión. Hay una diferencia significativa entre los puntos de fusión y los puntos de ebullición: los sólidos tienen una estructura más rígida y fija que los líquidos. Esta estructura rígida requiere energía para poder romperse durante la fusión. Entonces, las estructuras sólidas mejor construidas requerirán mayor energía para la fusión. Para los alcanos, esto puede verse en el gráfico anterior. Los alcanos de longitud impar tienen puntos de fusión ligeramente menores que los esperados, comparados con los alcanos de longitud par. Esto es debido a que los alcanos de longitud par se empacan bien en la fase sólida, formando una estructura bien organizada, que requiere mayor energía para romperse. Los alcanos de longitud impar se empacan con menor eficiencia, con lo que el empaquetamiento más desordenado requiere menos energía para romperse.10
Los puntos de fusión de los alcanos de cadena ramificada pueden ser mayores o menores que la de los alcanos de cadena lineal, dependiendo nuevamente de la habilidad del alcano en cuestión para empacarse bien en la fase sólida: esto es particularmente verdadero para los isoalcanos (isómeros 2-metil), que suelen tener mayores puntos de fusión que sus análogos lineales.
Que también pueden ser modificados literalmente por fuersas de otros compuestos y alterar su peso atómico y su estructura misma.
Conductividad
Los alcanos son malos conductores de la electricidad y no se polarizan sustancialmente por un campo eléctrico.
Solubilidad en agua
No forman enlaces de hidrógeno y son insolubles en solventes polares como el agua. Puesto que los enlaces de hidrógeno entre las moléculas individuales de agua están apartados de una molécula de alcano, la coexistencia de un alcano y agua conduce a un incremento en el orden molecular (reducción de entropía). Como no hay enlaces significativos entre las moléculas de agua y las moléculas de alcano, la segunda ley de la termodinámica sugiere que esta reducción en la entropía se minimizaría al minimizar el contacto entre el alcano y el agua: se dice que los alcanos son hidrofóbicos (repelen el agua).
Solubilidad en otros solventes
Su solubilidad en solventes no polares es relativamente buena, una propiedad que se denomina lipofilicidad. Por ejemplo, los diferentes alcanos son miscibles entre sí en todas las demás proporciones.
Densidad
La densidad de los alcanos suele aumentar conforme aumenta el número de átomos de carbono, pero permanece inferior a la del agua. En consecuencia, los alcanos forman la capa superior en una mezcla de alcano-agua
COMPROMISO No 1
PARA VER.
Aquí encontrarás buena información para el estudio de los alcanos.
https://www.alonsoformula.com/organica/alcanos.htm
https://organica1.org/qo1/MO-CAP3.htm#_Toc476377090
https://www.slideshare.net/florpascussa/alcanosalquinos-y-alquenos
https://www.slideshare.net/verorosso/propiedades-y-reacciones-organica
https://www.sabelotodo.org/quimica/alcanos.html
COMPROMISO No 2
ELABORAR LAS FÓRMULAS ESTRUCTURALES Y MOLECULARES PARA LOS SIGUIENTES COMPUESTOS
| 2-metilpentano | 3,4,6-trimetiloctano |
| 2-cloro-3,5-dimetilhexano | 4-etil-2,8-dimetil-5-propilundecano |
| 2,3-Dimetilbutano | 4-Etil-2,2,7-trimetiloctano |
| 4,5-Dietil-3,6-dimetildecano | 3-Etil-2-metilpentano |
| 2-Metilbutano | 4-(1-Etilpropil)-2,3,5-trimetilnonano |
| 4-(1-Metiletil)heptano | Heptano |
COMPROMISO No 3
Para practicar la nomenclatura de alcanos, visita la siguiente pagina